Hanseatisches Oberlandesgericht, Urteil vom 28. März 2024, Az.: 3 U 52/22
Unmittelbarer Vergleich bei falscher Annahme von Vergleichbarkeit aufgrund missverständlicher Grafik
Entscheidungen in Leitsätzen
UWG § 3 Abs. 1, § 3a, § 5 Abs. 1 Satz 1 und Abs. 2 Nr. 1, § 8 Abs. 1 Satz 1 und Abs. 3 Nr. 1; HWG § 3
Leitsätze des Gerichts:
1. Ein unmittelbarer Vergleich liegt vor, wenn die angesprochenen Fachkreise zwar erkennen, dass die Ergebnisse zweier verschiedener Studien dargestellt werden, aber aufgrund der besonderen grafischen Darstellung der Studienergebnisse zu dem falschen Schluss gelangen, dass hier ausnahmsweise auch die Ergebnisse zweier verschiedener Studien unmittelbar miteinander vergleichbar seien.
2. Das kann auch der Fall sein, wenn die Darstellung zwar nicht innerhalb eines einzigen Diagramms erfolgt, aber durch unmittelbar nebeneinander angeordnete Diagramme mit identischer Skalierung der Vertikalachse und unter Verwendung identischer Farben für die Wiedergabe der Ergebnisse eines Wirkstoffs.
3. Um entsprechende vergleichende Werbeaussagen in wissenschaftlich abgesicherter Weise treffen zu können, bedarf es einer Head-to-Head-Untersuchung.
4. Sind mehrere Einzelangaben innerhalb eines Werbemittels Gegenstand jeweils gesonderter, auf das Werbemittel bezogener Anträge, so ist jeweils ein Verbot gemeint, das die einzelne Werbeangabe nicht für sich allein betrachtet, sondern im konkreten werblichen Umfeld erfasst, so wie sie sich aus der in Bezug genommenen Verbotsanlage ergibt, und zwar losgelöst von den anderen, ebenfalls angegriffenen Angaben.
5. Hieraus folgt, dass eine gesonderte Angabe nicht wegen des irreführenden Gehalts einer anderen gesondert angegriffenen Angabe verboten werden kann.
6. Es spricht jedoch nichts dagegen, ein werbliches Umfeld, das nicht Gegenstand eines gesonderten Angriffs ist, verbotsbegründend gleichermaßen für mehrere der gesonderten Angriffe heranzuziehen.
7. Hinsichtlich des Vorliegens eines Verfügungsgrundes bewegen sich die zeitlichen Anforderungen an ein hinreichend zügiges Vorgehen des Anspruchstellers in einem Bereich von ca. 6 bis 8 Wochen zwischen der Kenntnis vom Rechtsverstoß und der Stellung des Verfügungsantrags, wobei es im Bereich der Heilmittelwerbung sachgerecht ist, im Interesse der ordentlichen Vorbereitung des Verfügungsverfahrens tendenziell einen großzügigeren Maßstab anzulegen.
Gründe
I.
1 Die Parteien streiten über Äußerungen der Antragsgegnerin für das Arzneimittel X.
2 Wegen des Sach- und Streitstandes erster Instanz wird zunächst gemäß § 540 Abs. 1 Satz 1 Nr. 1 ZPO auf das angefochtene Urteil verwiesen.
3 Die Parteien sind konkurrierende Pharmaunternehmen im Bereich von sogenannten GLP-1 Rezeptor-Agonisten. Dies sind Arzneimittel, die bei der Behandlung von Patienten mit Diabetes mellitus Typ 2 zur Senkung des Blutzuckers eingesetzt werden. Der rote Blutfarbstoff, Hämoglobin („Hb“) besteht beim Menschen aus vier Untergruppen: HbA0, HbA1, HbA2 und HbF. Auch der Hämoglobin-Typ HbA1 besteht aus mehreren Untergruppen. Eine davon heißt HbA1c, ein Wert der heute bevorzugt bei der Kontrolle des Blutzuckers gemessen wird.
4 Die Antragstellerin vertreibt in Deutschland den GLP-1 Rezeptor-Agonisten Y. mit dem Wirkstoff Dulaglutid (Fachinformation in Anlage AST 1). Das Präparat ist in einem sofort gebrauchsfertigen Fertigpen in den Darreichungsformen 0,75 mg, 1,5 mg, 3 mg und 4,5 mg Injektionslösung erhältlich und wird jeweils einmal wöchentlich angewendet.
5 Die Antragsgegnerin vertreibt in Deutschland den GLP-1 Rezeptor-Agonisten X. mit dem Wirkstoff Semaglutid (Fachinformation in Anlage AST 2). Das Präparat ist als Injektionslösung in einem Fertigpen in den Darreichungsformen 0,25 mg, 0,5 mg und 1 mg erhältlich und wird ebenfalls einmal wöchentlich angewendet.
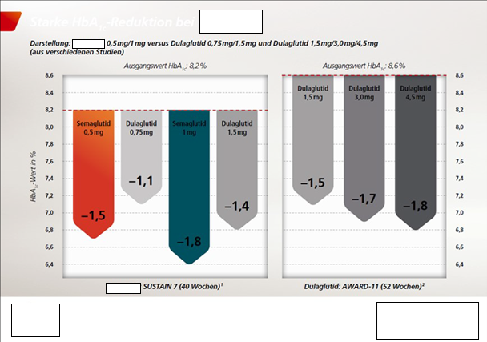
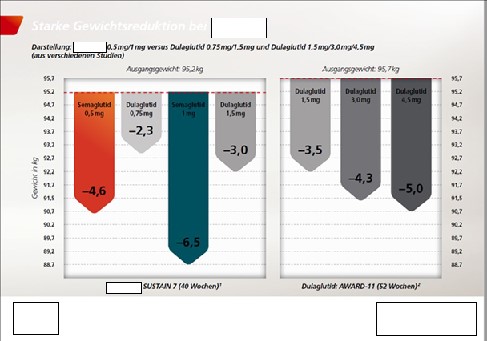
6 In der Studie SUSTAIN 7 (Anlage AG 5) wurden Semaglutid 0,5 mg und 0,75 mg und Dulaglutid 0,75 mg und 1,5 mg verglichen. Der primäre Endpunkt war die Änderung des HbA1c-Wert und sekundärer Endpunkt die Änderung des Gewichts der Probanden, beides jeweils nach 40 Wochen.
7 In der Studie AWARD-11 wurden Dulaglutid 1,5 mg, 3,0 mg und 4,5 mg hinsichtlich einer Änderung des HbA1c-Werts und des Gewichts der Probanden nach 36 und 52 Wochen verglichen.
8 In der Vergleichsstudie Pratley et al. (Anlage AST 7 = AG 6) wurde anhand der sog. Methode nach Bucher ein „indirect treatment comparison“ zwischen Semaglutid 1,0 mg und Dulaglutid 3,0 mg einerseits und Semaglutid 1,0 mg und Dulaglutid 4,5 mg andererseits vorgenommen. Grundlage des Vergleichs waren die Vergleiche von
9 Semaglutid 1,0 mg vs. Dulaglutid 1,5 mg in SUSTAIN 7,
10 Dulaglutid 3,0 mg vs. Dulaglutid 1,5 mg in AWARD-11 und
11 Dulaglutid 4,5 mg vs. Dulaglutid 1,5 mg in AWARD-11.
12 Die Antragsgegnerin warb in einer Werbeunterlage wie aus Anlage AST 3 (= Anlage 1 zum Tenor) ersichtlich mit einer „Darstellung der Studienergebnisse: SUSTAIN 7 und AWARD-11“.
13 Ferner warb sie mit einem Beileger über die Fachzeitschrift „Medical Tribune“, Ausgabe 04/2022, wie aus Anlage AST 4 (= Anlage 2 zum Tenor) ersichtlich.
14 Die bei der Antragstellerin ab dem Jahr 2020 für die Entscheidung über die Verfolgung von Wettbewerbsverstößen im Bereich der Diabetespräparate zuständige Mitarbeiterin in der Rechtsabteilung, Frau K., nahm die Werbeunterlage in Anlage 1 „Mitte Februar 2022“ erstmals zur Kenntnis (eidesstattliche Versicherung in Anlage AST 10). Kurz vor Fertigstellung der entsprechenden Abmahnung wurde ihr am 23.02.2022 die Werbeunterlage in Anlage 2 weitergeleitet. Nach Rückfrage bei der Fachabteilung erhielt sie am 01.03.2022 die Information, dass diese Werbung als Beileger über die Fachzeitschrift „Medical Tribune“, Ausgabe 04/2022, veröffentlicht worden war. Mit Blick auf die kritische Haltung der Wettbewerbsgerichte gegenüber zeitlich versetzten Beanstandungen von Wettbewerbsverstößen entschied sie sich, dass die Beanstandung auch dieser Unterlage in den Entwurf der bereits begonnenen Abmahnung eingearbeitet werde. Am Mittwoch, den 02.03.2022 wurde Frau K. positiv auf COVID-19 getestet. Im Laufe des Tages zeigten sich bei ihr erste Symptome der Infektion, aufgrund derer sie am 03. und 04.03.2022 nur noch sehr eingeschränkt tätig sein konnte. Über das Wochenende wurden die Symptome dann so stark, dass sie nicht länger in der Lage war, ihrer Arbeit nachzugehen. Sie wurde deshalb für die Zeit vom 07. bis 16.03.2022 krankgeschrieben (Anlage AST 9). Unmittelbar nach ihrer Genesung finalisierte sie die Abmahnung und verschickte sie am 17.03.2022 an die Antragsgegnerin (Anlage AST 5). In der Zeit ihrer Erkrankung war ihr Kollege in der Rechtsabteilung, Herr Dr. J., vom 07. bis einschließlich 14.03.2022 in einem lange geplanten und nicht verschiebbaren Urlaub. Da die bisherige dritte Justiziarin, Frau G., die Rechtsabteilung Anfang des Jahres 2022 verlassen hatte, war während der Zeit der Erkrankung von Frau K. kein Jurist verfügbar, der die Abmahnung an ihrer Stelle hätte finalisieren und versenden können.
15 Die Antragsgegnerin gab mit E-Mail vom 24.03.2022 (Anlage AST 6) teilweise eine Unterlassungsverpflichtungserklärung ab und verteidigte die übrigen Aussagen als rechtmäßig.
16 Am 05.04.2022 hat die Antragstellerin einen Antrag auf Erlass einer einstweiligen Verfügung gestellt.
17 Hinsichtlich der Anlage 1 hat die Antragstellerin vorgetragen, dass die Antragsgegnerin in vergleichenden Darstellungen die Wirksamkeit von Y. und X. hinsichtlich der Reduktion des HbA1c-Wertes sowie des Gewichts von mit den entsprechenden Arzneimitteln behandelten Patienten gegenüberstelle. Dabei würden in beiden Grafiken deutlich bessere Werte für X. als für Y. dargestellt und dies nicht nur durch in orange und blau gehaltene Pfeil-Balken gegenüber den in grauer Farbe gehaltenen Werten für Y., sondern auch durch die Überschriften über den vergleichenden Darstellungen „Starke HbA1c-Reduktion bei X.®“ und „Starke Gewichtsreduktion bei X.®“.
18 Diese angebliche Überlegenheit ergebe sich jedoch nicht aus einer Head-to-Head-Studie, sondern lediglich aus einer literarischen Gegenüberstellung von Ergebnissen aus den zwei unterschiedlichen Studien SUSTAIN 7 und AWARD-11. Da beide Studien unterschiedliche Patientenpopulationen, Studiendesigns und Methoden aufwiesen, verbiete sich schon deshalb ein Vergleich der Ergebnisse zu Werbezwecken. Die aus der AWARD-11 Studie für Y. dargestellten Ergebnisse nach 52 Wochen gäben auch nur das Ergebnis eines sekundären, explorativen Endpunktes wieder, während sich die Daten aus SUSTAIN 7 für X. auf primäre Endpunkte bezögen. Damit seien sie erst recht nicht für einen Vergleich geeignet. Den in der Werbung enthaltenen Hinweis, dass die verglichenen Daten „aus verschiedenen Studien“ stammten, deute ein relevanter Teil der angesprochenen Ärzte im Rahmen der Gesamtdarstellung so, dass die im Vergleich dargestellten Daten für die HbA1c-Senkung und Gewichtsreduktion durch Y. und X. trotz des Umstands, dass sie aus verschiedenen Studien stammten, durchaus miteinander verglichen werden könnten.
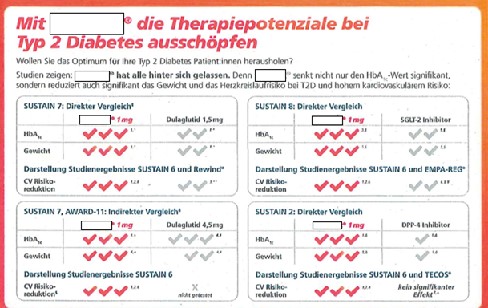
19 Hinsichtlich der Anlage 2 hat die Antragstellerin vorgetragen, dass die Werbung mit diversen vergleichenden Darstellungen der Ergebnisse von Studien mit X. in der Dosierung 1 mg und anderen Wirkstoffen (u.a. auch vs. Dulaglutid 1,5 mg und 4,5 mg) in dem ersten Block mit der Überschrift „Mit X.® die Therapiepotenziale bei Typ 2 Diabetes ausschöpfen“ irreführend sei, weil eine solche Überlegenheitsbehauptung nur auf Basis von Head-to-Head-Studien, jedenfalls aber von vergleichbaren Studien zulässig wäre, die eine signifikante Überlegenheit von X. in relevanten Wirksamkeits- und Sicherheits-Parametern gegenüber allen anderen Vergleichsmedikationen zur Behandlung von Typ 2 Diabetes ergeben müssten. Daran fehle es. Aber auch die Studienvergleiche selbst seien grob irreführend. In dem Kasten mit der Überschrift „SUSTAIN 7: Direkter Vergleich“ sei die im unteren Teil vorgenommene vergleichende „Darstellung der Studienergebnisse SUSTAIN 6 und Rewind“ zur CV Risikoreduktion von Dulaglutid 1,5 mg und X. 1 mg entgegen der Überschrift kein „direkter Vergleich“. Die Darstellung einer angeblichen Überlegenheit von X. in dem Kasten mit der Überschrift „SUSTAIN 7, AWARD-11: Indirekter Vergleich“ basiere nicht auf einer Head-to-Head-Studie und sei daher unzulässig. Darüber hinaus sei die Anzahl der Haken in den Vergleichs-Darstellungen sachlich nicht begründbar.
20 Die in der Mitte des Werbebeilegers gemäß Anlage 2, Seite 1 zu findende Aussage „Weniger Injektionen“ sei in ihrer konkreten Ausgestaltung irreführend, denn mangels weiterer Konkretisierung werde ein relevanter Teil der angesprochenen Verkehrskreise diese Aussage im Kontext des Beilegers angesichts des unmittelbar darüber positionierten Vergleichs u.a. auch mit Dulaglutid in den Wirkstärken 1,5 und 4,5 mg und die Behauptung einer Überlegenheit von X. gegenüber diesen Arzneimitteln auch auf diese beziehen. Diese Behauptung treffe für Dulaglutid jedoch nicht zu, da auch Y. nur mit einer Injektion pro Woche angewendet werde.
21 Die Antragstellerin hat in erster Instanz zuletzt beantragt, der Antragsgegnerin bei Meidung der gesetzlichen Ordnungsmittel zu verbieten,
22 im Rahmen geschäftlicher Handlungen für das Arzneimittel X.® (Wirkstoff: Semaglutid) wie folgt zu werben und/oder werben zu lassen:
23 1. Mit der nachfolgend wiedergegebenen Darstellung von Ergebnissen der Studien SUSTAIN 7 und AWARD-11
24 a.) zur Reduktion des HbA1c-Wertes durch eine Therapie mit Semaglutid versus eine Therapie mit Dulaglutid:
25 und/oder
26 b.) zur Reduktion des Gewichtes durch eine Therapie mit Semaglutid versus eine Therapie mit Dulaglutid
27 jeweils wie geschehen in der als Anlage 1 in Kopie beigefügten Unterlage
28 und/oder
29 2. Mit der nachfolgend wiedergegebenen Darstellung von Studienergebnissen
30 wie geschehen in der als Anlage 2 in Kopie beigefügten Unterlage
31 und/oder
32 3. Mit der Aussage
33 Weniger Injektionen
34 wie geschehen in der als Anlage 2 in Kopie beigefügten Unterlage.
35 Die Antragsgegnerin hat beantragt,
36 den Antrag auf Erlass einer einstweiligen Verfügung zurückzuweisen.
37 Die Antragsgegnerin hat hinsichtlich der Anlage 1 geltend gemacht, dass kein Verfügungsgrund vorliege. Wann die Kenntnisnahme „Mitte Februar 2022“ gewesen sein solle, bleibe unklar. Selbst wenn man unterstelle, dass die Kenntnisnahme erst am 15.02.2022 erfolgt sei, seien bis zur Einreichung der Antragsschrift sieben Wochen verstrichen. Hinzu komme, dass die Antragsgegnerin erst über einen Monat nach Kenntnisnahme abgemahnt worden sei. Frau K. hätte zwischen dem 02. und 07.03.2022 die Sache noch an ihren Kollegen Dr. J. in der Rechtsabteilung oder den ständig für die Antragstellerin tätigen Rechtsanwalt Dr. B. weitergeben können. Bei dieser Sachlage habe die Antragstellerin zudem nach der Abmahnungserwiderung nicht weitere zwölf Tage warten dürfen, um den Verfügungsantrag einzureichen.
38 Hinsichtlich der Anlage 1 fehle es auch am Verfügungsanspruch. Die Ärzte würden gleich an vier Stellen darauf hingewiesen, dass es hier um zwei unterschiedliche Studien gehe, nämlich SUSTAIN 7 und AWARD-11. Den angesprochenen Ärzten sei bekannt, dass sich Patientenpopulationen, Studiendesigns und Methoden unterschiedlicher Studien immer unterschieden. Die Studienergebnisse nach 40 Wochen bei SUSTAIN 7 und 52 Wochen bei AWARD-11 seien miteinander vergleichbar, denn die Ergebnisse bei AWARD-11 seien nach 36 Wochen und 52 Wochen vergleichbar hoch gewesen. Unzweifelhaft hätte die Antragsgegnerin gegenüber Ärzten mit der Aufforderung werben können, die Fachinformationen zur HbA1c- und Gewichtsreduktion zu vergleichen. Dann hätte sich den Ärzten kein anderes Bild geboten. Eine Überlegenheit von X. werde im Übrigen nicht behauptet. Es sei nur von einer „starken“ und nicht „stärkeren“ Reduktion die Rede.
39 Dass ein durchschnittlich informierter und verständiger Arzt die Angabe „Weniger Injektionen“ in Anlage 2 als Behauptung einer Überlegenheit zu Dulaglutid 1,5 mg oder 4,5 mg auffasse, sei fernliegend und werde bestritten. Auf die Vergleiche in den Kästen darüber werde der Arzt die Angabe nicht beziehen. Der letzte Kasten, den der Arzt lese, sei derjenige in Bezug auf den DDP-4 Inhibitor, der oral einzunehmen sei. Die Angabe „Weniger Injektionen“ trage dem dem Arzt bekannten Umstand Rechnung, dass die meisten anderen Antidiabetika häufiger als einmal wöchentlich zu injizieren seien. Im Rahmen der Prüfung des Antrags zu 3. könne zudem ohnehin nicht auf die mit dem Antrag zu 2. beanstandete Darstellung zurückgegriffen werden, um eine Irreführung durch die Darstellung mit der Überschrift „Weniger Injektionen“ zu begründen. Dies beruhe auf der Rechtsprechung des erkennenden Senats bzgl. des Hinwegdenkens von gesondert beanstandeten Teilen bei der Bestimmung der Irreführung. Soweit die Antragstellerin erstmals in der mündlichen Verhandlung vor dem Landgericht geltend gemacht habe, dass die Darstellung auch für sich genommen irreführend sei, weil damit auf alle anderen Antidiabetika und damit auch auf Dulaglutid Bezug genommen werde, sei diese Beanstandung nicht mehr dringlich.
40 Mit Urteil vom 23.05.2022 hat das Landgericht den Verfügungsanträgen stattgegeben. Hinsichtlich der Begründung wird auf die angegriffene Entscheidung verwiesen.
41 Mit ihrer Berufung wendet sich die Antragsgegnerin nur gegen die Verurteilung nach den Anträgen zu 1. und 3. Sie wiederholt und vertieft insoweit ihren erstinstanzlichen Vortrag.
42 Hinsichtlich der Anlage 1 fehle es auch deshalb am Verfügungsgrund, weil die Kenntnisnahme durch Frau K. „Mitte Februar 2022“ genauso gut am 10.02.2022 erfolgt sein könne. Dann seien fast acht Wochen bis zur Einreichung des Verfügungsantrags verstrichen. Krankheits- sowie urlaubsbedingte Abwesenheiten seien im Berufsalltag gewöhnliche Vorgänge, die es seitens der Antragstellerin im Rahmen ihrer betrieblichen Organisation abzufedern gelte. Darüber hinaus hätte die spätere Kenntnis von der Werbeunterlage gemäß Anlage 2 die Antragstellerin nicht gehindert, unabhängig davon bereits gegen die Unterlage gemäß Anlage 1 vorzugehen. Die beiden Unterlagen seien in den von der Antragstellerin beanstandeten Teilen inhaltlich gänzlich unterschiedlich. Hinzu komme, dass die Antragstellerin tatsächlich schon seit der Herbsttagung der Deutschen Diabetesgesellschaft am 5./6.11.2021, bei der beide Parteien unstreitig mit Messestände vertreten waren, Kenntnis von der streitgegenständlichen Werbung habe. Die Antragsgegnerin habe auf ihrem Messestand die Werbekarte gemäß Anlage AG 10 zur Mitnahme durch die Tagungsbesucher ausgelegt und die Seiten 1 bis 3 dieser Werbekarte seien mit den Seiten 1 bis 3 der Anlage 1 identisch. Es sei üblich und äußerst naheliegend, dass sich Wettbewerber auf Messen gegenseitig besuchten und das ausliegende Werbematerial mitnähmen.
43 Hinsichtlich der Anlage 1 fehle es auch am Verfügungsanspruch. Eine Überlegenheit von X. werde nicht in Anspruch genommen. Dass die eigenen Produkte des Werbenden farblich hervorgehoben würden, sei ein geläufiges Mittel der Werbung, an das der Arzt gewöhnt sei. Wie im Urteil des Senats vom 28.09.2006 – 3 U 259/05, Magazindienst 2007, 1070, juris Rdnr. 88 lägen die Voraussetzungen für einen zulässigen mittelbaren Vergleich von Studien vor. Die Studie von Pratley et al. belege, dass ein indirekter Vergleich von SUSTAIN 7 und AWARD 11 zulässig sei. Es stelle eine jedem Arzt bekannte Binsenweisheit dar, dass ein indirekter Vergleich nicht die gleiche Aussagekraft wie ein direkter Vergleich haben könne.
44 Hinsichtlich der Anlage 2 sei die Antragstellerin bzgl. der Darstellung gemäß dem Verfügungsantrag zu 2. erfolgreich gewesen. Die Darstellung, in der die HbA1c- und Gewichtsreduktion vergleichend zwischen X. 1 mg und Dulaglutid 1,5 mg bzw. 4,5 mg angeführt sei und aus der die Antragstellerin herleite, dass der Arzt die darunter befindliche Aussage „Weniger Injektionen“ so verstehen werde, dass damit die Anzahl der Injektionen im Vergleich zu Dulaglutid angesprochen sei, existiere somit nicht mehr. Zu einer „kontextfreien“ Irreführung habe die Antragstellerin in dringlichkeitsunschädlicher Zeit nichts vorgetragen.
45 Die Antragsgegnerin beantragt:
46 Unter Abänderung von Ziff. I. des Urteils des Landgerichts Hamburg vom 23.05.2022 Az. 416 HKO 35/22 wird die einstweilige Verfügung des Landgerichts Hamburg vom 23.05.2022 Az. 416 HKO 35/22 in Ziffn. I.1. lit. a und b sowie 3. aufgehoben und der Antrag auf Erlass einer Einstweiligen Verfügung vom 05.04.2022 in Ziffn. I.1. lit. a und b sowie 3. lit. a zurückgewiesen.
47 Die Antragstellerin beantragt,
48 die Berufung der Antragsgegnerin gegen das Urteil des Landgerichts Hamburg vom 23. Mai 2022 (Az.: 416 HKO 35/22) zurückzuweisen.
49 Die Antragstellerin verteidigt die angegriffene Entscheidung unter Wiederholung und Vertiefung ihres erstinstanzlichen Vortrags.
50 Hinsichtlich der Anlage 1 sei ein Verfügungsgrund gegeben. Zwischen Kenntniserlangung von der Werbeunterlage und Übersendung der Abmahnung habe ein atypischer Geschehensablauf stattgefunden. Es sei ab dem 07.03.2022 kein juristischer Mitarbeiter der Antragstellerin da gewesen, der die Abmahnung hätte absenden bzw. eine Abmahnung über die anwaltlichen Vertreter hätte freigeben können. Hätte die Antragstellerin die beiden Werbemittel getrennt beanstandet, hätte die Antragsgegnerin gegenüber der zweiten Beanstandung mit Sicherheit den Einwand einer rechtsmissbräuchlichen Vermehrung wettbewerbsrechtlicher Auseinandersetzung erhoben. Der erstmals in der Berufungsinstanz und damit verspätete Vortrag zur Herbsttagung der Deutschen Diabetesgesellschaft am 5./6.11.2021 ändere nichts daran, dass mit der eidesstattlichen Versicherung in Anlage AST 10 glaubhaft gemacht sei, dass die für die Entscheidung über die Verfolgung von Wettbewerbsverstößen im Bereich der Diabetespräparate zuständige Frau K. die Werbeunterlage gemäß Anlage 1 erstmals Mitte Februar 2022 zur Kenntnis genommen habe. Der Antragstellerin sei die als Anlage AG 10 vorgelegte Werbekarte auf der Herbsttagung nicht zur Kenntnis gelangt.
51 Wegen der weiteren Einzelheiten des Sach- und Streitstands wird auf die Schriftsätze der Parteien nebst Anlagen sowie das Protokoll der Berufungsverhandlung vom 14.03.2024 Bezug genommen.
II.
52 Die zulässige Berufung der Antragsgegnerin ist unbegründet. Das Landgericht hat der Antragsgegnerin das beanstandete Verhalten zu Recht untersagt.
53 1. Der Verfügungsantrag zu 1. ist zulässig und begründet.
54 a) Der Antragstellerin steht der geltend gemachte Unterlassungsanspruch aus § 8 Abs. 1 Satz 1, Abs. 3 Nr. 1, § 3 Abs. 1, § 3a, § 5 Abs. 1, Abs. 2 Nr. 1 UWG i. V. m. § 3 HWG zu.
55 Inwieweit der Antragsgegnerin eine unzulässige Überlegenheitsbehauptung vorzuwerfen ist, bedarf keiner Entscheidung, da der grafische Vergleich, den die Antragstellerin zwischen den Ergebnissen der Studien SUSTAIN 7 und AWARD-11 angestellt hat, schon als solcher unzulässig ist. Insoweit ist nach der Rechtsprechung des Senats zwischen einem unmittelbaren und einem mittelbaren Vergleich von Studienergebnissen zu unterscheiden (Urteil vom 28.09.2006 – 3 U 259/05, Magazindienst 2007, 1070, juris Rdnr. 71 ff. zum unmittelbaren Vergleich und Rdnr. 86 ff. zum mittelbaren Vergleich). Ein unmittelbarer Vergleich erfolgt danach dann, wenn die angesprochenen Fachkreise zwar erkennen, dass die Ergebnisse zweier verschiedener Studien dargestellt werden, aber aufgrund der besonderen grafischen Darstellung der Studienergebnisse zu dem falschen Schluss gelangen, dass hier ausnahmsweise auch die Ergebnisse zweier verschiedener Studien unmittelbar miteinander vergleichbar seien. Eine solche Darstellung liegt vor, wenn die Ergebnisse der jeweiligen Studien nicht unabhängig voneinander dargestellt werden. Das kann auch der Fall sein, wenn die Darstellung zwar nicht innerhalb eines einzigen Diagramms erfolgt, aber durch unmittelbar nebeneinander angeordnete Diagramme mit identischer Skalierung der Vertikalachse und unter Verwendung identischer Farben für die Wiedergabe der Ergebnisse eines Wirkstoffs.
56 So liegt der Fall auch hier. Die Studienergebnisse der Studien SUSTAIN 7 und AWARD-11 werden zwar nicht innerhalb eines einzigen Diagramms dargestellt und die Antragsgegnerin weist ausdrücklich darauf hin, dass die Ergebnisse „aus verschiedenen Studien“ stammen. Die Art der Darstellung, nämlich die unmittelbar nebeneinander angeordneten Pfeildiagramme mit identischer Skalierung der Vertikalachse und die Verwendung von Grautönen für die Wiedergabe der Ergebnisse für Dulaglutid führt jedoch dazu, dass aufgrund der suggestiven Kraft dieser grafischen Darstellung bei den angesprochenen Fachkreisen der falsche Eindruck erweckt wird, dass die hier gegenübergestellten Daten aus den beiden Studien unmittelbar miteinander vergleichbar seien. Um entsprechende vergleichende Werbeaussagen in wissenschaftlich abgesicherter Weise treffen zu können, hätte es jedoch einer Head-to-Head-Untersuchung bedurft (vgl. Senat, PharmR 2022, 451 Rdnr. 70).
57 b) Die Antragsgegnerin hat auch die Vermutung des Verfügungsgrunds gemäß § 12 Abs. 1 UWG nicht widerlegt.
58 aa) Dass ein Mitarbeiter der Antragstellerin die Werbung gemäß Anlage AG 10, die im Rahmen der Herbsttagung der Deutschen Diabetesgesellschaft am 5./6.11.2021 ausgelegen haben soll, tatsächlich zur Kenntnis genommen hat, hat die Antragsgegnerin nicht dargelegt und glaubhaft gemacht. Allein der pauschale Vortrag, dass es üblich und äußerst naheliegend sei, dass sich Wettbewerber auf Messen gegenseitig besuchten und das ausliegende Werbematerial mitnähmen, genügt nicht. Im Übrigen ist grundsätzlich nur das Wissen der Personen maßgeblich, die im Unternehmen für die Vermittlung und/oder Geltendmachung von Wettbewerbsverstößen zuständig sind (Senat, Urteil vom 31.01.2019 – 3 U 204/17, juris Rdnr. 65). Die zuständige Mitarbeiterin K. hat jedoch an Eides statt versichert, die Werbeunterlage „Darstellung der Studienergebnisse: SUSTAIN 7 und AWARD-11“ erstmals Mitte Februar 2022 zur Kenntnis genommen zu haben (Anlage AST 10).
59 bb) Nach dieser Kenntnisnahme hat die Antragstellerin die Sache noch ausreichend zugig behandelt.
60 Die Entscheidungen des Hanseatischen Oberlandesgerichts zu den zeitlichen Anforderungen an ein hinreichend zügiges Vorgehen des Anspruchstellers bewegen sich in einem Bereich von ca. 6 bis 8 Wochen zwischen der Kenntnis vom Rechtsverstoß und der Stellung des Verfügungsantrags, wobei es im Bereich der Heilmittelwerbung sachgerecht ist, im Interesse der ordentlichen Vorbereitung des Verfügungsverfahrens tendenziell einen großzügigeren Maßstab anzulegen. Dem Anspruchsteller ist im Übrigen ein umso zügigeres Handeln nach der Zurückweisung der Abmahnung abzuverlangen, wenn zwischen der Kenntnis vom Wettbewerbsverstoß und dem Ausspruch der Abmahnung bereits viel Zeit vergangen ist. Ein Zeitraum von 5 ½ Wochen absoluter Untätigkeit zwischen Kenntnis und Abmahnung kann dabei schon für sich genommen dringlichkeitsschädlich sein (Senat, WRP 2019, 917, juris Rdnr. 46 ff. m.w.N.).
61 Im Streitfall lagen selbst dann, wenn von einer Kenntnisnahme am 10.02.2022 auszugehen wäre, zwischen der Kenntnisnahme und der Abmahnung am 17.03.2022 fünf Wochen und zwischen der Kenntnisnahme und der Einreichung des Verfügungsantrags am 05.04.2022 sieben Wochen und fünf Tage. Damit hielt sich die Antragstellerin noch im dargestellten zeitlichen Rahmen. Aufgrund der zweiwöchigen Erkrankung der zuständigen Mitarbeiterin K. und des gleichzeitigen Urlaubs ihres Kollegen Dr. J. lagen zudem besondere Umstände vor, die eine schnellere Bearbeitung nicht möglich gemacht haben. Die Einschaltung externer Rechtsanwälte hätte nicht zu einer Beschleunigung geführt, da auf Seiten der Antragstellerin kein Mitarbeiter zur Verfügung gestanden hätte, um die Abmahnung freizugeben. Es ist auch nicht zu beanstanden, dass sich die Mitarbeiterin K. vor ihrer Erkrankung dazu entschieden hat, die Werbemittel in den Anlagen 1 und 2, die beide Vergleiche von X. mit Dulaglutid betrafen, zusammen abzumahnen.
62 2. Der Verfügungsantrag zu 3. ist ebenfalls zulässig und begründet.
63 a) Auch insoweit steht der Antragstellerin der geltend gemachte Unterlassungsanspruch aus § 8 Abs. 1 Satz 1, Abs. 3 Nr. 1, § 3 Abs. 1, § 3a, § 5 Abs. 1, Abs. 2 Nr. 1 UWG i. V. m. § 3 HWG zu.
64 aa) Bei der Bestimmung, wie der angesprochene Verkehr die Angabe „Weniger Injektionen“ im Rahmen der nachfolgend eingeblendeten Darstellung versteht, kann auf die Erwähnung von Dulaglutid in der mit dem Antrag zu 2. angegriffenen Verletzungsform zurückgegriffen werden:

65 (1) Sind mehrere Einzelangaben innerhalb eines Werbemittels Gegenstand jeweils gesonderter, auf das Werbemittel bezogener Anträge, so ist jeweils ein Verbot gemeint, das die einzelne Werbeangabe nicht für sich allein betrachtet, sondern im konkreten werblichen Umfeld erfasst, so wie sie sich aus der in Bezug genommenen Verbotsanlage ergibt, und zwar losgelöst von den anderen, ebenfalls angegriffenen Angaben. Hieraus folgt, dass eine gesonderte Angabe nicht wegen des irreführenden Gehalts einer anderen gesondert angegriffenen Angabe verboten werden kann. Wegen der Maßgeblichkeit des werblichen Gesamtzusammenhangs ist jedoch der etwaig aufklärende Inhalt einer gesondert angegriffenen Angabe auch bei der Ermittlung des Verständnisses anderer gesondert angegriffener Angaben (ggf. irrtumsausschließend) zu berücksichtigen. Es spricht zudem nichts dagegen, ein werbliches Umfeld, das nicht Gegenstand eines gesonderten Angriffs ist, verbotsbegründend gleichermaßen für mehrere der gesonderten Angriffe heranzuziehen (Senat, PharmR 2014, 13, juris Rdnr. 44; Senat, GRUR-RR 2015, 485, juris Rdnr. 78; Senat, PharmR 2015, 457, juris Rdnr. 69; Senat, Urteil vom 21.01.2016 – 3 U 38/15, juris Rdnr. 67; Senat, Urteil vom 09.11.2017 – 3 U 246/16, juris Rdnr. 155; OLG Hamm, PharmR 2023, 299, juris Rdnr. 68; vgl. auch BGH, Urteil vom 21.12.2023 – I ZR 24/23, juris Rdnr. 23 f. – Corona-Prophylaxe).
66 (2) Im Streitfall wird der Wirkstoff Dulaglutid in dem oberen Block auf der ersten Seite des Werbebeilegers gemäß Anlage 2 zweimal erwähnt, nämlich einmal in dem kleinen Kasten „SUSTAIN 7: Direkter Vergleich“ und einmal in dem darunter liegenden Kasten „SUSTAIN 7, AWARD-11: Indirekter Vergleich“. Den ersten Kasten hat die Antragstellerin unter dem Gesichtspunkt angegriffen, dass die im unteren Teil dieses Kastens vorgenommene vergleichende „Darstellung der Studienergebnisse SUSTAIN 6 und Rewind“ entgegen der Überschrift „SUSTAIN 7: Direkter Vergleich“ kein „direkter Vergleich“ sei. Außerdem hat sie die Hakendarstellungen beanstandet. Da Gegenstand der Studie SUSTAIN 7 ein direkter Vergleich von X. 1,0 mg und Dulaglutid 1,5 mg in Bezug auf die Senkung von HbA1c und des Gewichts war, hat die Antragstellerin den Kasten unter diesem Gesichtspunkt mit Recht nicht beanstandet. Jedenfalls die Erwähnung von Dulaglutid in diesem Kasten ist somit nicht Teil der von der Antragstellerin mit dem Antrag zu 2. angegriffenen Angabe, so dass diese Erwähnung bei der Bestimmung des Verkehrsverständnisses hinsichtlich der mit dem Antrag zu 3. angegriffenen Angabe „Weniger Injektionen“ nicht hinweggedacht werden muss.
67 bb) Auf Grund der vorangehenden Erwähnung von Dulaglutid hat der angesprochene Verkehr Anlass anzunehmen, dass sich die Aussage „Weniger Injektionen“ auch auf einen Vergleich mit Dulaglutid bezieht. Allein auf den DPP-4 Inhibitor, der im kleinen Kasten unten rechts genannt wird, den der Arzt möglicherweise als letztes gelesen hat, bevor er zum Claim „Weniger Injektionen“ gelangt, wird er diesen Claim schon nach dem eigenen Vortrag der Antragsgegnerin nicht beziehen, denn wie der angesprochene Verkehr weiß, ist der DPP-4 Inhibitor oral einzunehmen und nicht zu spritzen.
68 cc) Die Behauptung, dass bei der Verwendung von X. weniger Injektionen nötig seien als bei Dulaglutid, ist unstreitig unzutreffend, da beide Präparate nur einmal pro Woche gespritzt werden müssen.
69 b) Die Vermutung des Verfügungsgrunds ist auch bzgl. dieses Verfügungsantrags nicht widerlegt. Auf den oben genannten Irreführungsaspekt hat sich die Antragstellerin unstreitig bereits in der Antragsschrift gestützt. Es kann daher dahinstehen, ob die Antragstellerin die Behauptung, dass die Angabe „Weniger Injektionen“ auch ohne den Kontext des darüber liegenden Teils der Anlage 2 irreführend sei, erst in dringlichkeitsschädlicher Zeit geltend gemacht hat.
70 3. Die Kostenentscheidung folgt aus § 97 Abs. 1 ZPO. Ein Ausspruch zur vorläufigen Vollstreckbarkeit ist nicht veranlasst, da das Urteil des Senats gemäß § 542 Abs. 2 Satz 1 ZPO rechtskräftig und ohne Weiteres vollstreckbar ist (vgl. Senat, Urteil vom 12.10.2023 – 3 U 60/22, juris Rdnr. 94; KG, Urteil vom 22.02.2023 – 5 U 49/21, juris Rdnr. 38 m.w.N.).
71 4. Die Streitwertfestsetzung folgt aus § 51 Abs. 2, Abs. 4 GKG.